Pourquoi
utilise-t-on l'aluminium pour l'emballage alimentaire ?
Pourquoi une boite de conserve en fer ne rouille-elle pas ?
1)TP
N° 1 Une expérience de formation de la rouille
TP3°1
TP
N°1 Formation de la rouille
1)
But Interpréter
une expérience de formation de la rouille 2)
Mode opératoire a)Matériel :
1 bécher, 2 tubes, eau, papier filtre, limaille de fer b)Manipulation Placer
au fond d’un tube un papier filtre humide saupoudré de limaille de fer. Placer
au fond du 2° tube un papier filtre humide. (témoin) Indiquer
le niveau de l’eau dans le becher au début de l’expérience. Apr Questions : -A
quoi le tube témoin sert-il ? -Quelles
sont les modifications observées dans le tube ? -Quelles
sont les modifications observées dans le becher ? -Quelles sont les modifications observées dans sur le papier ?
|
1)But:
Interpréter une expérience de formation de la rouille
2)Manipulation
Matériel:1
bécher, 2 tubes, eau, papier filtre, limaille de fer
Rappel des consignes de sécurité:
-
Porter une blouse
-
Avoir les cheveux attachés
-
Dégager la paillasse
-
Mettre les cartables sous les paillasses
-
Faire attention aux autres
-
Manipuler debout
-
Manipuler la verrerie avec précaution
On
place
au fond du tube 1 un papier filtre humide saupoudré de limaille de
fer.
On prépare un tube témoin en plaçant au fond du 2° tube un papier filtre humide.
On
indique
le niveau de l’eau dans le becher au début de l’expérience.
Schéma du montage
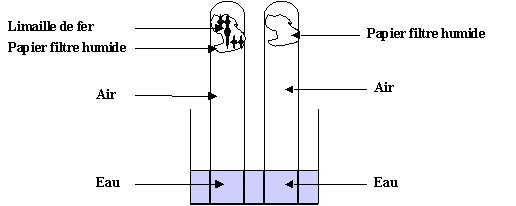
3)Observations
Après une semaine on observe:

Le niveau de l'eau à légèrement baissé dans le bécher .et n'a pas changé dans le tube témoin
Il n'y a aucun changement dans le tube témoin, ce qui montre que d'action de l'air et de l'eau sur le papier ne sont pas responsables des modifications observées dans le tube 1
Dans le tube 1:
-
le niveau de l'eau a monté, 1/5 du volume d'air a disparu
-
de la rouille s'est formée
-
du fer a disparu
On peut formuler l'hypothèse suivante: c'est le dioxygène de l'air qui a disparu.
On le vérifie en mettant une allumette enflammée dans le tube 1 après l'avoir retourné celle-ci s'éteint.
Le tube 1 ne contient plus de dioxygène à la fin de l'expérience
4)Conclusion
La
formation de la rouille est une réaction chimique au cours de
laquelle du fer et du dioxygène disparaissent tandis que de la rouille se
forme. Les réactifs sont le dioxygène et le fer, le produit est la
rouille.
2)
Interprétation de la formation de la rouille
-
Le fer est constitué d’atomes de fer (Fe).
-
Le dioxygène est constitué de molécules de dioxygène (O2).
Au cours de la formation de la rouille les
atomes de fer et les atomes d’oxygène se recombinent pour former des
oxydes de fer. La rouille est un mélange d’oxydes de fer.
On
dit que la formation de de la rouille est une oxydation.
Au cours de l’expérience le fer n’a pas rouillé en totalité car la quantité de dioxygène était insuffisante. Par contre à l’air libre la fer rouille jusqu’à sa disparition totale. Sur le fer la rouille se détache facilement et permet ainsi son oxydation en profondeur.
C’est
une oxydation lente du fer
3)Facteurs de formation de la rouille
0n réalise l'expérience suivante
|
eau salée + air |
eau minérale + air |
eau pure + air |
eau |
air + chlorure de calcium (déshydratant) |
|
|
|
|
|
|
-
En présence d’eau et d’air (tubes 1, 2, 3) le clou rouille.
-
Dans le tube 4 , sans air le clou ne rouille pas.
-
Dans le tube 5 sans humidité, le clou ne rouille pas.
Le
clou ne rouille qu’en présence d’air humide.
Dans le tube 1 , en présence de sel, le clou rouille de façon plus importante.
Certaines
substances comme le sel, favorisent la formation de la rouille
Un fil d’aluminium chauffé dans une flamme fond mais ne coule pas.
La
partie chauffée se recouvre d’une pellicule blanche d’oxyde
d’aluminium ou alumine, qui le protège d’une oxydation en profondeur.
L’alumine ne fond pas dans la flamme du bec bunsen.
A
froid l’aluminium s’oxyde lentement à l’air. Il se recouvre d’une
fine couche d’alumine qui le protège.
5)
Activité expérimentale p 40 : Protéger le fer contre la rouille
Pour
protéger le fer contre la rouille on peut le recouvrir de différents
substances
-
- de peinture carrosserie

- de matières plastiques, grillage
- de céramique,
- d’un corps gras (protection provisoire)
- d’étain (fer blanc)
- de zinc (galvanisation)
Ou
faire un alliage avec du nickel et du chrome (acier inoxydable)
Les
coques des navires sont protégées par des électrode sacrificielles en
zinc qui s’oxydent à la place de l’acier
Ex
19 p 45
6)Étude
du document p 41 L’aluminium un poids plume