1)Combustion
du fer dans l’air
Un fil de fer placé dans une flamme rougit mais ne
brûle pas dans l’air.
|
|
De la limaille de fer projetée dans une flamme brûle
dans l’air avec formation d’étincelles. Il se forme de petits grains
gris d’oxyde de fer. |
Lorsque le fer est finement divisé
(poudre), il brûle dans l’air.
2) Interprétation de la combustion du fer
On réalise l’expérience suivante :
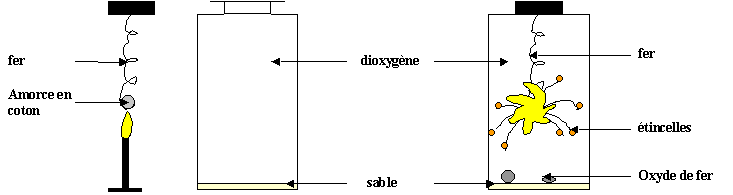
La combustion du fer dans le dioxygène est très vive, avec projection d’étincelles et dégagement de chaleur important.
Après quelques instants la combustion cesse car tout le dioxygène du flacon est épuisé.
Il
s'est formé des petits globules gris d’oxyde de
fer.
Le
sable au fond du bocal à pour rôle de le protéger
de la chaleur.
La combustion du fer dans l’air ou le dioxygène est une réaction chimique au cours de laquelle du fer et du dioxygène réagissent pour former un oxyde de fer.
C’est une
réaction exoenergétique.
3)
Equation-bilan de la combustion du fer
Bilan
de cette réaction chimique :
Fer
+ dioxygène ![]() oxyde de fer
oxyde de fer
Le fer est constitué d’atomes de fer symbole (Fe
Le
dioxygène est constitué de molécules de dioxygène symbole
(O2).
Le
produit est un oxyde fer (oxyde magnétique de fer) qui a pour formule Fe3O4.
Equation-bilan :
Fe
+ O2 ![]() Fe3O4
Fe3O4
Equilibrons
cette équation-bilan voir
(FM 14 : Equilibrer l’équation-bilan d’une réaction chimique)
![]() Fe3O4
Fe3O4
Au
cours de la réaction
chimique les atomes présents dans les réactifs se réarrangent et se
retrouvent en même nombre dans les produits. Les coefficients placés
devant les formules
traduisent la conservation des atomes.
La
masse de l’oxyde fer formé est égale à la somme des masses de dioxygène
et de fer disparus.
Au
cours de toute réaction chimique il y a conservation des atomes et de la
masse.
4)Activtié
expérimentale p 52 Utiliser la conservation de la masse
Schéma 2 p 52
-
Avant la combustion le fer est gris et brillant, après la combustion il a été en partie remplacé par un solide noir
-
La pile est en court-circuit ce qui chauffe la laine de fer et provoque sa combustion.
-
Les réactifs de cette réaction chimique, sont le fer et le dioxygène, le produit est un oxyde de fer.
-
L'augmentation de masse est de 0.9 g. Elle est due à l'union d'atome d'oxygène provenant du dioxygène de l'air avec les atomes de fer.
-
Curiosus a tort car dans la première pesée on ne pèse pas le dioxygène qui va réagir avec le fer.
Au cours d'une réaction chimque, la masse totale de tous les réactifs est égale à la somme des masses des produits formés
5)Combustion de l’aluminium, du zinc et du cuivre.
|
|
De la poudre d’aluminium projetée dans une flamme brûle vivement en
projetant des étincelles. Il se forme une poudre blanche d’oxyde
d’aluminium (alumine). |
Au
cours de cette réaction chimique de l’aluminium (Al)
et du dioxygène (O2)
disparaissent pour former un oxyde d’aluminium qui a pour formule Al2O 3
Bilan
de cette réaction chimique
Aluminium
+ dioxygène ![]() oxyde d’alumnium
oxyde d’alumnium
Equation-bilan
4Al
+
3 O2 ![]() Al2O 3
Al2O 3
Cette
réaction chimique est une oxydation elle est exoénergétique.
|
|
De la poudre de zinc projetée dans une flamme brûle vivement avec des étincelles et formation d’une fumée blanche d’oxyde de zinc. |
Au cours de cette réaction chimique du
zinc (Zn) et du dioxygène O2
disparaissent pour former un oxyde de zinc
qui a pour formule ZnO
Bilan de cette réaction
Zinc
+ dioxygène ![]() oxyde de zinc
oxyde de zinc
Equation-bilan
2Zn
+
O2
![]() 2ZnO
2ZnO
Cette
réaction chimique est une oxydation elle est exoénergétique
|
|
De la poudre de cuivre projetée dans une flamme brûle émettant une lumière verte. Il se forme une poudre noire d’oxyde de cuivre. |
Au
cours de cette réaction chimique du cuivre (Cu) et du dioxygène
(O2)
disparaissent pour former un oxyde de cuivre qui a pour formule CuO
Bilan de cette réaction
Cuivre
+ dioxygène ![]() oxyde de cuivre
oxyde de cuivre
2Cu
+
O2 ![]() 2CuO
2CuO
Cette
réaction chimique est une oxydation elle est exoénergétique
6)Activité
documentaire p 53 Une bombe
de poussières.



