|
Objectifs: |
|
| Extraire des informations d'une documentation | |
| Décrire la constitution d'un ion à partir d'un atome | |
Observons une étiquette d'eau minérale. Elle nous informe sur la teneur en ion. Qu'est-ce qu'un ion ?

1 La conduction électrique dans les solutions
Les métaux sont tous conducteurs du courant électrique. En est-il de même pour les solutions aqueuses ?
Proposons une expérience pour le montrer
Activité p 23
La DEL s'éclaire lorsqu'elle est parcourue par un courant électrique
L'eau distillée et une solution aqueuse de saccharose ne conduisent pas le courant électrique.
Les eaux minérales et une solution aqueuse de chlorure de sodium ou de sulfate de cuivre conduisent le courant électrique
Les solutions aqueuses qui conduisent le courant électrique contiennent des particules électriquement chargées qu'on appelle des ions et qui peuvent se déplacer dans la solution. On les appelle des solutions ioniques ou électrolyte.
Les solutions qui ne conduisent pas le courant électrique ne contiennent que des molécules
2)
Nature du courant électrique dans les solutions
Comment les ions se déplacent-ils dans une solution ?
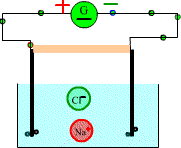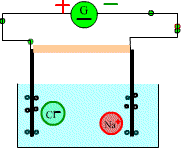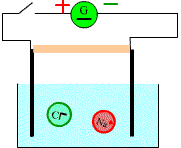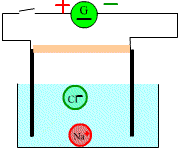
Réalisons
une expérience de migration des ions.
Etat initial
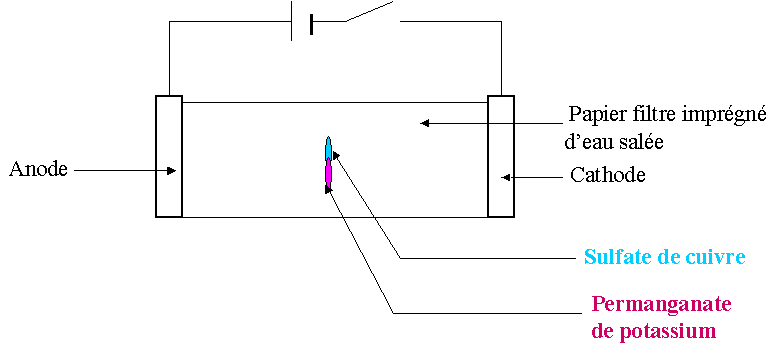
On ferme le circuit:
A près un moment on observe
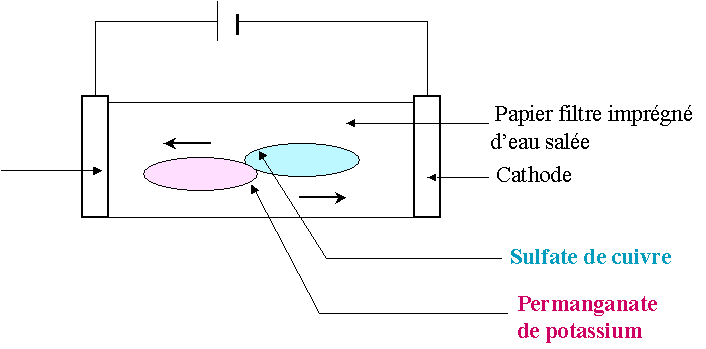
Après quelques minutes on constate qu’une tache bleue s’étend vers la cathode et une tache violette vers l’anode.
Les cristaux de sulfate de cuivre libèrent des ions cuivre et des ions sulfate
Les ions cuivre positifs
(responsables de la couleur bleue) ont migré vers la cathode tandis que les ions négatifs
responsables
de la couleur violette ont migré vers l'anode.
Le courant électrique dans une solution est du à la double migration des anions et des cations se déplaçant en sens inverse.
3) Constitution d'un ion
L'ion cuivre Cu 2+ provient d'un atome de cuivre qui a cédé 2 électrons. Il est chargé positivement
Un
ion positif ou cation
est un atome ou groupe d’atome qui a perdu un ou plusieurs électrons.
Un
ion négatif ou anion est un atome ou groupe d’atomes qui a capté un ou
plusieurs électrons.
Activité p 40 Comment écrire la formule d'un ion
Exemple: l’atome de Sodium Na possède 11 e- et 11 charges + dans son noyau.
Il
peut perdre un e- et devenir
l’ion sodium Na + qui possède 10e-
et 11 charges + dans son
noyau.
Ca
Z=20
20 électrons et 20 charges + peut devenir l’ion Ca 2+ (18
e- et
20 charges + ) en perdant 2 e-
Al
Z= 13 (13 e- et 13 charges +) peut perdre 3 e- et devenir l’ion
Al 3+ (10
e- et 13 charges +)
Ex:
l’atome de chlore Cl (17 e- et 17 charges +) peut capter un e-
et devenir l’ion chlorure Cl – (18 électrons et 17 charges
+).
Il
existe des ions plus complexes formés à partir de plusieurs atomes ex
| Ion sulfate SO4 2- |
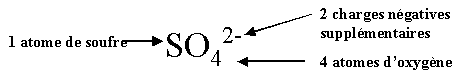 |
|
Ion
nitrate
NO3-
|
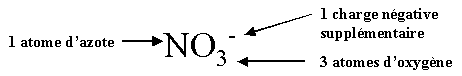 |
| Ion carbonate CO32- |
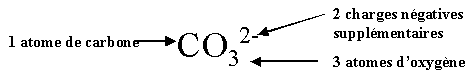 |
Les
ions possèdent le même noyau que l’atome correspondant et un nombre
d’électrons différent.
Dans
une solution ionique les charges électriques portées par les ions positifs compensent les
charges électriques portées par les ions négatifs
Une solution ionique est électriquement neutre.
exemple:
une solution d’eau salée contient des ions Na+ et des ions
Cl-. Elle
contient autant d’ions Na+ que d’ions Cl-.
Une
solution de chlorure d’aluminium contient des ions Cl- et des ions
Al 3+. Elle contient 3 fois plus d’ions Cl- que d’ions
Al 3+
pour assurer l’électroneutralité.
4)Formules de quelques ions
la formule d'un ion est constituée du symbole de l'atome à partir duquel il est formé et de la charge positive ou négative qu'il porte.
| Nom de l'ion | Formule |
| ion hydrogène | H+ |
| ion sodium | Na+ |
| ion zinc | Zn2+ |
| ion cuivre | Cu2+ |
| ion aluminium | Al3+ |
| ion ferreux | Fe2+ |
| ion ferrique | Fe3+ |
| ion hydroxyde | HO- |
| ion chlorure | Cl- |