Pourquoi le courant électrique circule-t-il dans un métal ?
1)Historique
des modèles de l’atome
Étude de documents
Un modèle est un "outil" qui permet de prévoir et d'interpréter certains phénomènes réels.
Un modèle scientifique est toujours provisoire. En effet, au fil des découvertes et des perfectionnements de l'instrumentation, un nouveau modèle devient nécessaire lorsque les faits ne peuvent être expliqués avec l'ancienne théorie.
|
|
 |
 |
 |
| Démocrite (-460-370) | Aristote (-384-322) | Dalton (1766-1844) | Avogadro(1776-1856) |
|
|
|
|
|
| Faraday(1791-1867) | Thomson(1856-1940) | Rutherford(1871-1937) | De Broglie (1892-1927) |
2)
La matière est constituée à partir d’atomes
Tous
les corps sont constitués à partir de particules infiniment petites :
les atomes.
Les
dimensions d’un atome sont de l’ordre de 0, 1 nanomètre. 1 nm = 10-9
m.
Un
atome est constitué d’un noyau et d’un nuage d'électrons qui
gravitent autour de lui.


Un
électron est une particule chargée d’électricité négative. Symbole
e-. On l’appelle charge électrique élémentaire car c’est
la plus petite charge électrique connue.
Chaque type d’atome possède un nombre déterminé d’électron que l’on appelle numéro atomique symbole Z.
L’atome
le plus simple est l’atome d’Hydrogène il possède 1 électron.
Tous
les électrons sont identiques quelque soit l’atome dont ils
proviennent.
Le
noyau porte des charges électriques positives. Ses dimensions sont
environ 100 000 fois plus petites que celle de l’atome mais sa masse
vaut plusieurs milliers de fois celle des électrons.
Un
atome est électriquement neutre. C’est à dire qu’il possède autant
de charges positives dans son noyau que d’électrons.
3) Classification périodique des éléments
Mendeleïev
a classé les atomes par nombre croissant d’électrons. C’est la
classification périodique des éléments .

L’atome
de fer possède 26 électrons et 26 charges + dans son noyau.
Les étiquettes d’eau minérales observées en 4° montraient la présence d’ions de 2 types (positifs ou négatifs)
exemples: l’ion chlorure Cl- et l’ion sodium Na+

Un
ion positif ou cation
est un atome ou groupe d’atome qui a perdu un ou plusieurs électrons.
Exemple: l’atome de Sodium Na possède 11 e- et 11 charges + dans son noyau.
Il
peut perdre un e- et devenir
l’ion sodium Na + qui possède 10 e- et 11 charges + dans son
noyau.
Ca
Z=20
20 électrons et 20 charges + peut devenir l’ion Ca 2+ (18 e- et
20 charges + ) en perdant 2 e-
Al
Z= 13 (13 e- et 13 charges +) peut perdre 3 e- et devenir l’ion
Al 3+ (10
e- et 13 charges +)
Un
ion négatif ou anion est un atome ou groupe d’atomes qui a capté un ou
plusieurs électrons.
Ex:
l’atome de chlore Cl (17 e- et 17 charges +) peut capter un e-
et devenir l’ion chlorure Cl – (18 électrons et 17 charges
+).
Il
existe des ions plus complexes formés à partir de plusieurs atomes ex
| Ion sulfate SO4 2- |  |
|
Ion
nitrate
NO3-
|
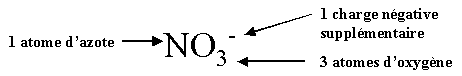 |
| Ion carbonate CO32- | 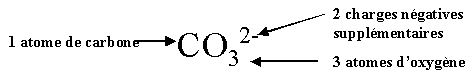 |
Les
ions possèdent le même noyau que l’atome correspondant et un nombre
d’électrons différent.
5)
Le courant électrique dans les métaux
Tous les métaux conduisent le courant électrique. Les atomes des métaux possèdent des électrons périphériques faiblement liés au noyau. Ces électrons peuvent quitter l’atome et se déplacer dans le métal. On les appelle électrons libres.

Sous l’action d’une tension électrique ces électrons libres prennent un mouvement d’ensemble vers la borne positive du générateur. C’est le courant électrique.
Le sens
de déplacement des électrons est opposé au sens conventionnel du
courant électrique.
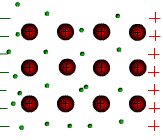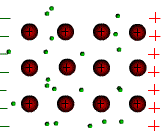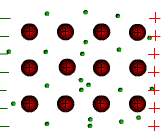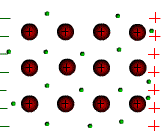
6)
Le courant électrique dans les solutions
Une solution conduit le courant électrique si elle contient des ions. On l’appelle électrolyte.
Une solution ionique est électriquement neutre.
Les charges électriques portées par les ions positifs compensent les
charges électriques portées par les ions négatifs
exemple:
une solution d’eau salée contient des ions Na+ et des ions
Cl-. Elle
contient autant d’ions Na+ que d’ions Cl-.
Une
solution de chlorure d’aluminium contient des ions Cl- et des ions
Al 3+. Elle contient 3 fois plus d’ions Cl- que d’ions
Al 3+
pour assurer l’électroneutralité.
.
Ex 14 p 32
Réalisons
une expérience de migration des ions.
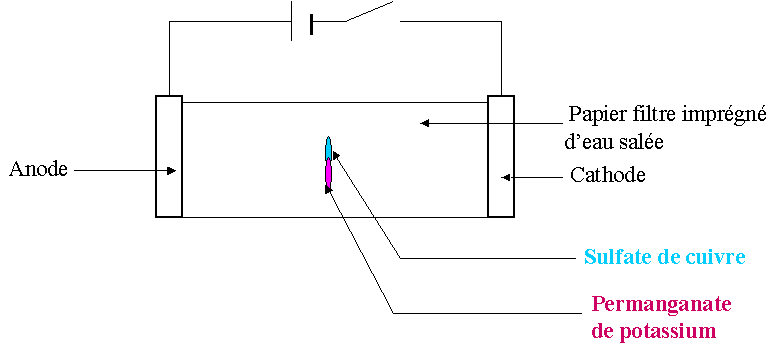
On
ferme le circuit:
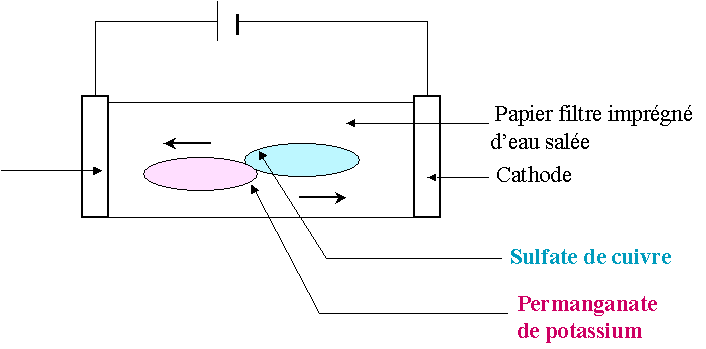
Après quelques minutes on constate qu’une tache bleue s’étend vers la cathode et une tache violette vers l’anode.
Les ions positifs
Cu
2+ (responsables de la couleur bleue) ont migré vers l'anode tandis que les ions négatifs MnO4-(responsables de la couleur violette)
ont migré vers la cathode.
Le
courant électrique dans une solution est du à la double migration des
anions et des cations se déplaçant en sens inverse.
exemple d'une solution de chlorure de sodium: Na+ + Cl-

7)Retrouver
la formule d’un ion à partir de l’atome
Voir
fiche méthode p 30
Ex
19 p 33
8)
Activité expérimentale p 28 Réaliser un dépôt de métal par électrolyse
9) Activité documentaire p 29 L’électricité au cœur de la matière.




