|
1) Les constituants de l'acide chlorhydrique
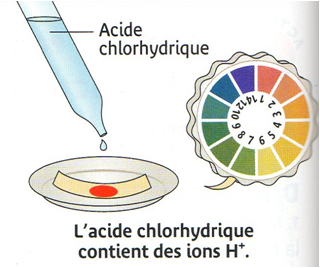 |
On verse de l’acide chlorhydrique dans
un bécher et on mesure son pH
La valeur du pH est égale à 1.
Le pH de cette solution est acide : cela
signifie que l’acide chlorhydrique contient des ions H+
|
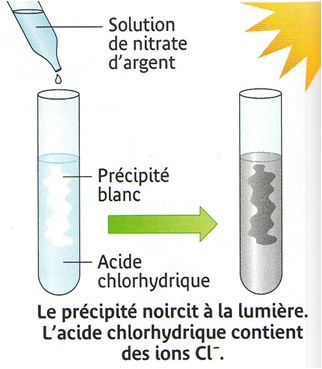 |
On verse quelques gouttes de solution de nitrate d’argent dans
de l’acide chlorhydrique. On observe la formation d’un précipité
blanc qui noircit à la lumière.
Ce précipité montre la présence d’ions chlorure Cl–
dans l’acide chlorhydrique.
|
L’acide chlorhydrique
contient des ions hydrogène H+ et des ions chlorure Cl–
en solution dans l’eau.
La formule ionique de
l’acide chlorhydrique est ( H+,Cl–).
1)
TP N° 2 Action de l'acide Chlorhydrique sur le fer
|
But : Etudier l’action de
l’acide chlorhydrique sur le fer. Identifier les produits cette
transformation et en écrire le bilan
Protocole expérimental : Avant
toute manipulation observer le pictogramme figurant sur la
bouteille d'acide chlorhydrique.

Attention
l’acide chlorhydrique est très corrosif. Revoir les consignes
de sécurité.
1)Identifier
les ions présents dans l'acide chlorhydrique (Réactif)
Determiner
le pH de la solution d'acide chlorhydrique dilué puis verser
une petite partie de l'acide dans un tube à essais et ajouter
quelques gouttes de nitrate d'argent. Observer et conclure
2)Réaliser la
transformation chimique
Verser dans un
tube à essais contenant de la limaille de fer, 2 mL d’acide
chlorhydrique
- Noter
vos observations
-
Après quelques instants approcher une flamme de l’entrée du tube
- Noter
vos observations
3)Identifier
les produits de la transformation
-
Observer la
solution restant dans le tube
-
Déterminer son pH
- Verser
quelques gouttes de soude dans la solution
- Noter
vos observations.
- Proposer
une explication
FM
24 test d’identification des ions ,
Questions pour vous aider à conclure
-
Quels sont les réactifs de cette réaction
chimique
-
Quels sont les ions présents dans
l’acide chlorhydrique ?
-
Quel est l’ion responsable de
l’acidité d’une solution ?
-
A quoi la modification du pH est-elle due ?
-
A quoi le test à la soude sert-il ?
-
Quels sont les ions présents dans la
solution à la fin de l’expérience ?
-
D’où proviennent-ils ?
-
Quels sont les produits de cette réaction
chimique ?
|
3E 12/01/17
| 2)
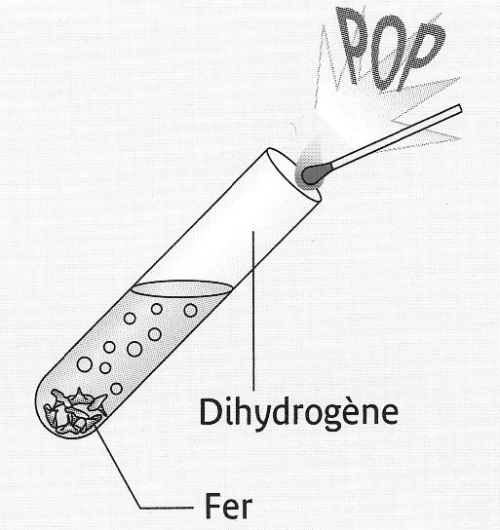
L'acide chlorhydrique réagit avec le fer
Lorsque l'on verse de
l'acide chlorhydrique sur la limaille de fer il se produit une
effervescence.
Un gaz se forme.
Ce gaz brûle dans
l'air en présence d'une
flamme en produisant un jappement qui caractérise le dihydrogène.
|
|
|
L'action
de l'acide chlorhydrique sur le fer produit du dihydrogène. |
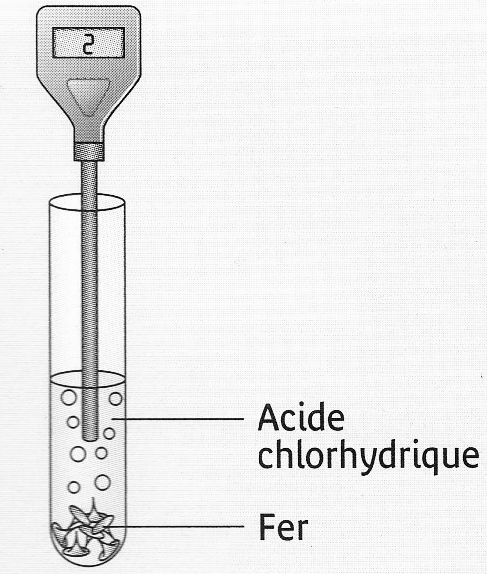
| Le pH de la solution
augmente donc la concentration en ion H+ diminue. Au cours de cette
transformation chimique des ions H+ sont
consommés |
 |
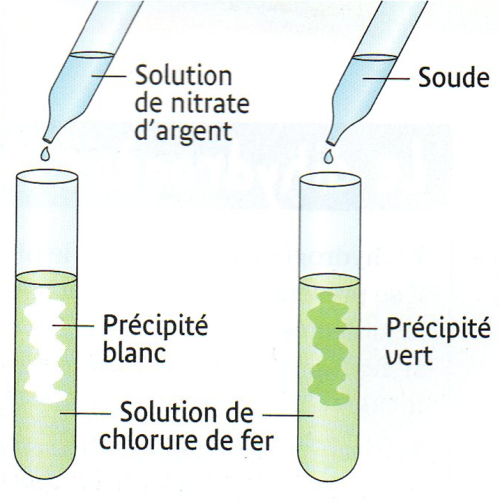
| 3)
Analyse de la solution après la réaction On
récupère la solution après filtration et on réalise deux tests
Test à la soude : il se forme un précipité vert qui
caractérise la présence d’ions fer II : Fe2+.
L'action de l'acide
chlorhydrique sur le fer a produit des ions Fe 2+.
Test au nitrate d’argent : il se forme un précipité blanc
qui caractérise la présence d’ions chlorure Cl–
Interprétation :
La solution obtenue qui contient des ions chlorure et des ions
fer II est une solution de chlorure de fer II. |
|
4)
Écrivons le bilan de cette transformation chimique
Le pH a augmenté donc ce sont les ions
H+ qui ont disparu et réagi avec le fer.
Les ions chlorures sont présents en même quantité avant et après la réaction,
donc ils ne participent pas à la réaction : ce sont des ions
spectateurs.
On en déduit que les réactifs de cette réaction sont le fer
et les ions hydrogène alors que les produits sont le dihydrogène
et les ions fer II.
Conclusion
:
On peut écrire le bilan
suivant :
Fer + acide chlorhydrique
→ dihydrogène + chlorure de fer II
ex 19 p 78
5)
Activité documentaire p 75
3°2 27/01/17
|





