Certains produits ménagers contiennent substances corrosives, c'est le cas de l'acide chlorhydrique ou de la soude du commerce. Quels matériaux peut-on utiliser pour fabriquer les récipients qui les contiennent ?
1)Formules de quelques ions
Il existe deux sortes d'ions:
-
les ions positifs ou cations
-
les ions négatifs ou anions
la formule d'un ion est constituée du symbole de l'atome à partir duquel il est formé et de la charge positive ou négative qu'il porte.
| Nom de l'ion | Formule |
| ion hydrogène | H+ |
| ion sodium | Na+ |
| ion zinc | Zn2+ |
| ion cuivre | Cu2+ |
| ion aluminium | Al3+ |
| ion ferreux | Fe2+ |
| ion ferrique | Fe3+ |
| ion hydroxyde | OH- |
| ion chlorure | Cl- |
| ion sulfate | SO42- |
| ion nitrate | NO3- |
2)Le pH des solutions
Le pH est un nombre qui permet d'évaluer l'acidité d'une solution.
| On le mesure à l'aide |
d'un pHmètre |
ou de papier pH |
|
|
|
|
voir FM Mesurer l'acidité d'une solution
L'eau pure est neutre. Elle a un pH de 7.
Le pH d'une solution est compris entre 1 et 14

Une solution basique a un pH supérieur à 7
Plus le pH est élevé, plus la solution est basique. Exemples: soude, savon, eau de Javel
Une solution acide a un pH inférieur à 7 ;
Plus le pH est faible, plus la solution est acide Exemples: acide chlorhydrique, jus de fruits, coca, perrier
3) Dangers des solutions acides et basiques
FM23 Savoir manipuler des liquides dangereux
| Les solutions acides
ou basiques du commerce sont concentrées.
Elle sont très corrosives et peuvent provoquer de graves brûlures. |

|
Pour les rendre moins dangereuses on les dilue.
|
|
Attention il ne faut jamais
verser de l'eau dans la base ou l'acide. Risque de projections
|
Les solutions acides et basiques présentent un danger pour l'environnement. Elles ne doivent pas être jetées dans l'évier mais stockées dans un bidon pour être traitées
Doc 3: 9 symboles de dangers
Doc 4: Lire une étiquette c'est déjà se protéger
4)Etude du document p 77: Les pluies acides
FM24 Tests d'identification des ions métalliques
5) Les constituants de l'acide chlorhydrique et de la soude
Une solution d'acide chlorhydrique contient des ions hydrogène H+ et des ions chlorure Cl-.
Elle contient autant d'ion H+ que d'ions Cl- (électroneutralité). Sa formule s'écrit H+ + Cl-
Ce sont les ions H+ qui sont responsables de l'acidité.
Plus la solution contient d'ions H+, plus elle est acide et plus son pH est faible.
Une solution de soude ou hydroxyde de sodium contient des ions hydroxyde OH- et des ions sodium Na+.
Elle contient autant d'ion OH- que d'ions Na+ (électroneutralité). Sa formule s'écrit Na+ + OH-
Ce sont les ions OH- qui sont responsables de la basicité.
Plus la solution contient d'ions OH- plus elle est basique et plus son pH est élevé.
6) TP N° 2 Test d'identification des ions
TP N°2 Test d’identification des ionsBut : Identifier les ions d’une solution. Matériel :Tubes a essais, solutions ioniques, soude, nitrate d’argent, chlorure de baryum.
Protocole expérimental : 1)Verser quelques gouttes de réactif dans des tubes contenant les solutions
2) Observer la couleur de la solution inconnue. Séparer la solution en 2 tubes. Faire le test de la soude sur un des tubes puis faire les autres test sur le 2° tube. Nommer l’anion et le cation de la solution
inconnue. Attention
la soude est une solution corrosive il faut la manipuler avec précaution. Revoir les consignes de sécurité.
|
| Tests |
test à la soude |
test au nitrate d'argent |
test au chlorure de Baryum |
|||
| Couleur du précipité | blanc | vert | rouille | bleu | blanc qui noirçit à la lumière | blanc |
|
ion identifié |
Al3+ ou Zn 2+ | Fe2+ | Fe3+ | Cu2+ | Cl- | SO42- |
|
|
|
|
|
|
|
|
7) TP N° 3 Action de l'acide Chlorhydrique sur les métaux
TP N°3 Action de l’acide chlorhydrique sur le ferBut : Etudier l’action de l’acide chlorhydrique sur le fer. Protocole expérimental : 1)Verser dans un tube à essais contenant de la limaille de fer, 2 mL d’acide chlorhydrique après en avoir déterminé le pH. Attention
l’acide chlorhydrique est très corrosif. Revoir les consignes
de sécurité.
2)Filtrer la solution restant dans le tube
Questions
|
Matériel:
| Lorsque l'on verse de l'acide chlorhydrique sur la limaille de fer il se produit une effervescence. Un gaz se forme. |
|
| Ce gaz brûle dans
l'air en présence d'une
flamme en produisant un jappement caractéristique du dihydrogène.
L'action de l'acide chlorhydrique sur le fer produit du dihydrogène. |
|
| Le pH de la solution
augmente donc la concentration en ion H+ diminue.
Au cours de cette réaction chimique des ions H+ disparaissent |
|
| Lorsque l'on ajoute de
la soude dans la solution restant à la fin de l'expérience, il se forme
un précipité vert qui montre la présence d'ions Fe 2+.
L'action de l'acide chlorhydrique sur le fer produit des ions Fe 2+. |
|
Equation-bilan de la réaction chimique
Fe
+ 2( H+
+ Cl-) ![]() H2 + (Fe 2+.+
2
Cl-)
H2 + (Fe 2+.+
2
Cl-)
Les ions Cl- de l'acide chlorhydrique ne sont pas modifiés au cours de la réaction. On dit qu'ils sont indifférents.
On peut écrire une équation bilan simplifiée
Fe + 2 H+
![]() H2 + Fe 2+.
H2 + Fe 2+.
Voir FM26 Équilibrer une équation chimique faisant intervenir des ions et FM27
De la même manière le zinc et l'aluminium réagissent avec l'acide chlorhydrique pour donner du dihydrogène.
Equation-bilan de ces réactions chimiques
| Zn + 2( H+
+ Cl-) |

|
| 2Al
+ 6( H+
+ Cl-) |
le cuivre ne réagit pas avec l'acide chlorhydrique
8)Action de la soude sur les métaux
On réalise l'expérience suivante
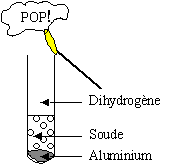
La soude réagit à froid avec l'aluminium il se forme de l'aluminate de sodium. et du dihydrogène
Soude
+ Aluminium ![]() Dihydrogène + Aluminate de sodium
Dihydrogène + Aluminate de sodium
Elle réagit à chaud avec le zinc, il se forme du zincate de sodium et du dihydrogène.
Soude
+ Zinc ![]() Dihydrogène + Zincate de sodium
Dihydrogène + Zincate de sodium
Le fer et le cuivre ne réagissent pas avec la soude.
La soude réagit vivement avec l'aluminium, plus lentement avec le zinc en produisant du dihydrogène.
9)Inertie de certains matériaux.
Le verre et la plupart des matières plastiques ne réagissent pas avec les acides ni avec les bases. L'abandon de ces matériaux non dégradables est une des source de pollution des milieux naturels.
Les acides et les bases peuvent être stockés dans des récipient en matière plastiques ou en verre.
10)Activité expérimentale p 88 : Identifier des ions avant et après une réaction chimique
11)
Activité documentaire p 89: A quoi sert le zinc d'une pile ?