Les molécules sont-elles les plus petites particules qui puissent exister ? Comment modéliser une transformation chimique
Nous avons vu en 5° que l’eau est constituée de molécules toutes identiques. 41 18/11/15
Silhouette

En fait une molécule est constituée de plusieurs atomes liés entre eux.
Une molécule d’eau est formée d’un atome d’oxygène liée à 2 atomes d’hydrogène.
On représente les atomes par des sphères et les molécules par des modèle moléculaire.
Modèle de la
molécule d’eau

On peut aussi représenter une molécule par une formule chimique.
Le symbole de l’atome d’hydrogène est H.
Le symbole de l’atome d’oxygène est O
La formule de la molécule d’eau est H2O. Le petit 2 placé derrière le H signifie que la molécule d’eau comporte 2 atomes d’hydrogène
2) Construisons quelques modèles moléculaire
Symboles à connaître Modèle de l'atome
Atome d’hydrogène H boule blanche
Atome d’oxygène O boule
rouge
Atome de carbone C boule noir
Atome d’azote
N boule
bleu
| Nom de la molécule |
Formule |
Composition en atomes | Modèle moléculaire | Corps simple ou composé |
| Eau |
H20 |
1atome d’oxygène 2 atomes d’hydrogène |
|
corps composé |
| Dihydrogène | H2 | 2 atomes d’hydrogène |
|
Corps simple |
| Dioxygène | 02 | 2 atomes d’oxygène |
|
Corps simple |
| Diazote | N2 | 2 atomes d’azote |
|
Corps simple |
| Dioxyde de carbone | CO2 | 1 atome de carbone 2 atomes d’oxygène |
|
corps composé |
| Méthane | CH4 | 1 atome de carbone 4 atomes d’hydrogène |
|
corps composé |
41 9/12/16
3)Modélisation d'une transformation chimique
Bilan de la combustion du carbone
|
Carbone |
+ |
dioxygène |
|
dioxyde de carbone |
proposons une modélisation de cette transformation chimique
|
|
+ |  |
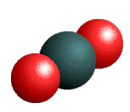 |
Bilan de la combustion du méthane
|
Méthane |
+ |
dioxygène |
|
dioxyde de carbone |
+ |
eau |
Modèles moléculaires
 |
+ |
|
|

|
+ |
 |
|
Complétons le tableau dénombrant les différents atomes de chaque sorte intervenant dans cette transformation chimique 42 9/12/16
| Atomes | Symboles | Nombre total parmi les réactifs | Nombre total parmi les produits |
Les réactifs et les produits possèdent autant d'atomes de chaque sorte
Au cours de cette transformation chimique, une molécule de méthane CH4 réagit avec 2 molécules de dioxygène O2.
Elles se brisent et les atomes se recombinent pour former une molécule de dioxyde de carbone CO2 et deux molécules H2O
Au cours d’une transformation chimique les atomes constituant les molécules des
réactifs se regroupent d’une autre façon pour former les molécules des
produits
équation-bilan
de la combustion du méthane
|
CH4 |
+ |
2O2 | CO2 |
+ |
2H2O |
Une transformation chimique conserve la nature et le nombre des atomes mais pas les molécules.
On place devant les formules des molécules des coefficients pour avoir autant d’atomes de chaque sorte dans les produit et dans les réactifs
On dit que l’équation bilan est équilibrée.
Equation-bilan de la combustion du carbone.
![]()
5)Activité expérimentale p 63 Vérifier la conservation de la masse
Le calcaire réagit avec l’acide chlorhydrique pour former du dioxyde de carbone et d’autres corps.
Les corps présents dans le bocal au début de l’expérience sont le calcaire et l’acide chlorhydrique.
Au bout de 5 mn en plus des réactifs on trouve dans le bocal
-
du dioxyde de carbone
-
et un autre produit de la réaction chimique.
Au bout de15 mn on dans le bocal les produits de la réaction chimique et l’acide chlorhydrique en excès
Au cours d’une transformation chimique la masse se conserve 41 13/01/17
6)Activité documentaire p 66 et 67
